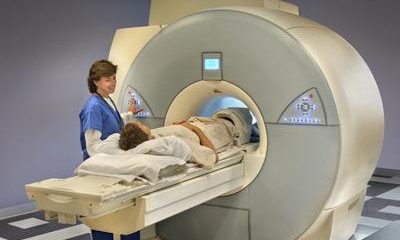
Компания Amgen заявила, что Управление по продуктам и лекарствам США (FDA) отказало в регистрации нового препарата для устранения гормонального дисбаланса, которым часто страдают пациенты, находящиеся на диализе
Amgen объявила, что в этом году собирается встретиться с представителями FDA, чтобы обсудить это решение. Пока регулятор не сообщил компании причины отказа.
Препарат этелькальцетид предназначен для лечения вторичного гиперпаратиреоза у пациентов, страдающих хронической болезнью почек и находящихся на гемодиализе. Лекарство вводится внутривенно.
Amgen приобрела этелькальцетид, также известный под названием Parsabiv, купив в июле 2012 года компанию KAI Pharmaceuticals за $315 млн. В сентябре 2015 года Amgen подала заявку на регистрацию лекарства сначала в FDA, а затем в Европейское агентство лекарственных средств (EMA).
По данным Amgen, вторичным гиперпаратиреозом страдают примерно 2 млн пациентов по всему миру, которые находятся на диализе, в том числе около 450 тысяч американцев.
Производитель надеялся, что препарат займет место старого средства от аналогичного заболевания – Sensipar (Циналкацет), который в прошлом году стал блокбастером.
В случае отказа в регистрации лекарственного средства FDA всегда отправляет заявителям документ с подробным описанием причин своего отрицательного решения, и почти в 20% случаев фармкомпании не обнародуют данные об отказе.
Amgen Inc – американская биофармацевтическая компания, основанная в 1980 году. Компания специализируется на производстве препаратов для лечения рака, заболеваний почек, ревматоидного артрита и других заболеваний. Выручка компании в 2015 году составила $21,7 млрд, прибыль – $7,9 млрд.
http://www.vademec.ru










You must be logged in to post a comment Login